Los tintes Fluo-8® están desarrollados para mejorar la carga celular y la respuesta de calcio mientras mantienen las cómodas longitudes de onda espectrales Fluo-3 y Fluo-4 de Ex/Em = ∼490/∼520 nm.
Descripción
Las mediciones de calcio son fundamentales para numerosas investigaciones biológicas. Las sondas fluorescentes que muestran respuestas espectrales al unirse a Ca2+ han permitido a los investigadores investigar los cambios en las concentraciones de Ca2+ libres intracelulares mediante microscopía de fluorescencia, citometría de flujo, espectroscopia de fluorescencia y lectores de microplacas de fluorescencia. Fluo-3 AM y Fluo-4 AM se utilizan más comúnmente entre los indicadores de calcio excitables por luz visible para la obtención de imágenes de calcio de células vivas. Sin embargo, Fluo-3 AM y Fluo-4 AM son solo moderadamente fluorescentes en células vivas tras la hidrólisis de esterasa y requieren de condiciones difíciles para cargar celulas s para maximizar sus respuestas de calcio celular.
Los tintes Fluo-8® están desarrollados para mejorar la carga celular y la respuesta de calcio mientras mantienen las cómodas longitudes de onda espectrales Fluo-3 y Fluo-4 de Ex/Em = ∼490/∼520 nm. Fluo-8® AM se puede cargar en células a temperatura ambiente, mientras que Fluo-3 AM y Fluo-4 AM requieren 37 °C para la carga de células. Además, Fluo-8® AM es dos veces más brillante que Fluo-4 AM y cuatro veces más brillante que Fluo-3 AM. AAT Bioquest ofrece un conjunto de nuestros destacados reactivos Fluo-8® con diferentes afinidades de unión al calcio (Fluo-8® Kd = 389 nM; Fluo-8H™ Kd = 232 nM; Fluo-8L™ Kd = 1,86 µM; Fluo-8FF ™ Kd = 10 µM).
También ofrecemos tamaños de envases versátiles para satisfacer sus necesidades especiales (p. ej., envases de 1 mg, 10 x 50 µg, 20 x 50 µg y HTS) sin cargo de embalaje adicional.
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-21080 | Fluo-8®, AM | 1 mg |
| AAT-21081 | Fluo-8®, AM | 5×50 ug |
| AAT-21082 | Fluo-8®, AM | 10 x 50 ug |
| AAT-21083 | Fluo-8®, AM | 20 x 50 ug |
Importante: Solo para uso en investigación (RUO). Almacenamiento: Congelar (< -15 °C); Minimizar la exposición a la luz
Plataforma
Microscopio de Fluorescencia
| Excitación | FITC |
| Emisión | FITC |
| Placa recomendada | Pared negra, fondo claro |
Lector de microplacas de fluorescencia
| Excitación | 490 nm |
| Emisión | 525 nm |
| Corte | 515 nm |
| Placa Recomendada | Pared negra, fondo claro |
| Especificaciones instrumento | Modo de lectura inferior/Manejo de líquidos programable |
PREPARACION DE SOLUCIONES DE STOCK
A menos que se indique lo contrario, todas las soluciones madre no utilizadas deben dividirse en alícuotas de un solo uso y almacenarse a -20 °C después de la preparación. Evite los ciclos repetidos de congelación y descongelación
Prepare una solución madre de 2 a 5 mM de Fluo-8® AM en DMSO anhidro de alta calidad.
PREPARACION DE SOLUCIONES DE TRABAJO
El día del experimento, disuelva Fluo-8® AM en DMSO o descongele una alícuota de la solución madre del indicador a temperatura ambiente. Prepare una solución de trabajo de tinte de 2 a 20 µM en un buffer de su elección (p. ej., buffer Hanks y Hepes) con Pluronic® F-127 al 0,04 %. Para la mayoría de las líneas celulares, se recomienda Fluo-8® AM a una concentración final de 4-5 μM. La concentración exacta de indicadores necesarios para la carga de células debe determinarse empíricamente.
Nota El detergente no iónico Pluronic® F-127 se usa a veces para aumentar la solubilidad acuosa de Fluo-8® AM. Se puede comprar una variedad de soluciones Pluronic® F-127 de AAT Bioquest.
Nota Si sus células contienen transportadores de aniones orgánicos, se puede agregar probenecid (1-2 mM) a la solución de trabajo del colorante (la concentración final en el pocillo será de 0,5-1 mM) para reducir la fuga de los indicadores desesterificados. Se puede comprar una variedad de productos de probenecid ReadiUse™, que incluyen sal de sodio soluble en agua y solución estabilizada, en AAT Bioquest.
Calculadora
Preparación de la solución de stock común
Volumen de DMSO necesario para reconstituir la masa específica de Fluo-8®, AM a la concentración dada. Tenga en cuenta que el volumen es solo para preparar la solución madre. Consulte el protocolo experimental de muestra para conocer los buffers experimentales/fisiológicos apropiados.
| 0.1 mg | 0.5 mg | 1 mg | 5 mg | 10 mg | |
| 1 mM | 95.517 µL | 477.587 µL | 955.174 µL | 4.776 mL | 9.552 mL |
| 5 mM | 19.103 µL | 95.517 µL | 191.035 µL | 955.174 µL | 1.91 mL |
| 10 mM | 9.552 µL | 47.759 µL | 95.517 µL | 477.587 µL | 955.174 µL |
Imagenes
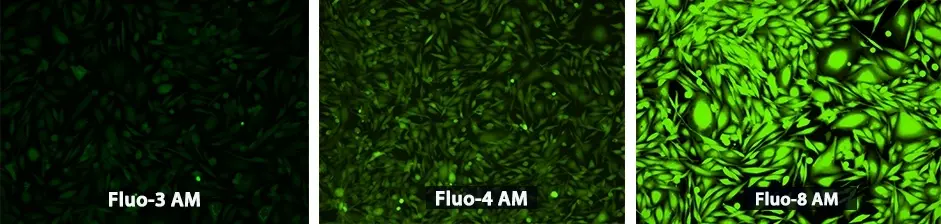
Figura 1. Se sembraron células U2OS durante la noche a 40 000 células/100 µl/pocillo en una placa costar de fondo transparente/pared negra de 96 pozos. Se retiró el medio de cultivo y se incubaron las células con, 100 µL de Fluo-3 AM, Fluo-4 AM y Fluo-8® AM , respectivamente, en HHBS a una concentración de 4 uM a una temperatura de 37 °C, CO2 al 5 % incubando durante 1 hora. Las células se lavaron dos veces con 200 µL de HHBS, luego se tomaron imágenes con un microscopio de fluorescencia (Olympus IX71) usando el canal FITC.

Figura 2. Diferencia en la intensidad de fluorescencia de a flexión de los músculos de las patas de insectos del escarabajo de control y el escarabajo después de la dosificación oral con indicadores químicos. (A) Fluo-8; (B) rodamina 123; (C) DiBAC4(3); (D) rodamina B; y (E) rastreador celular. La pata de escarabajo dosificada con Fluo-8, Rhodamine 123 y DiBAC4(3) se observó bajo una luz de excitación de 460–480 nm y la fluorescencia emitida se recogió dentro de 495–540 nm. La pata de escarabajo dosificada con Rhodamine B y Cell Tracker se observó bajo una luz de excitación de 535–555 nm y la fluorescencia emitida se recogió dentro de 570–625 nm. La intensidad de la fluorescencia se midió en las 2 regiones de interés (ROI) que se muestran en la figura S1A. Las imágenes obtenidas se digitalizaron con el software ImageJ y la intensidad promediada se muestra en cada gráfico de barras. Los gráficos de la columna de la derecha muestran las intensidades de fluorescencia de cada pata de escarabajo dosificada con diferentes indicadores químicos (centro) en comparación con la pata de escarabajo de control (izquierda). Los escarabajos controles se alimentaron con gelatina casera (sin indicador químico añadido) durante 2 días antes de la observación. Las barras de error representan la desviación estándar (S.D.) (N = 5 escarabajos, n = 30 patas de escarabajo para control, DiBAC4(3), rodamina B y rodamina 123; N = 9 escarabajos, n = 30 patas de escarabajo para Fluo-8 y rastreador celular). Cada conjunto de datos se comparó con el conjunto de datos de la pierna de control mediante la prueba t de Student (Fluo-8, p = 1,42 × 10-4; Rhodamine 123, p = 4,65 × 10-5; DiBAC4 (3), p = 6,26 × 10- 9; Rodamina B, p = 1,15×10-9 y Cell Tracker, p = 7,10×10-3). La escala de colores se encuentra en la esquina inferior izquierda de la imagen. El aumento en la intensidad de la fluorescencia para el escarabajo dosificado con indicador químico en comparación con el escarabajo control indica que el exitoso método de dosificación oral administrado y la entrega de varios indicadores químicos para etiquetar el músculo de la pata del escarabajo. bibliografía: Gráfico de dosificación oral de indicadores químicos para el control in vivo de la dinámica de Ca2+ en el músculo de insectos por Ferdinandus et al., PLOS, enero de 2015.
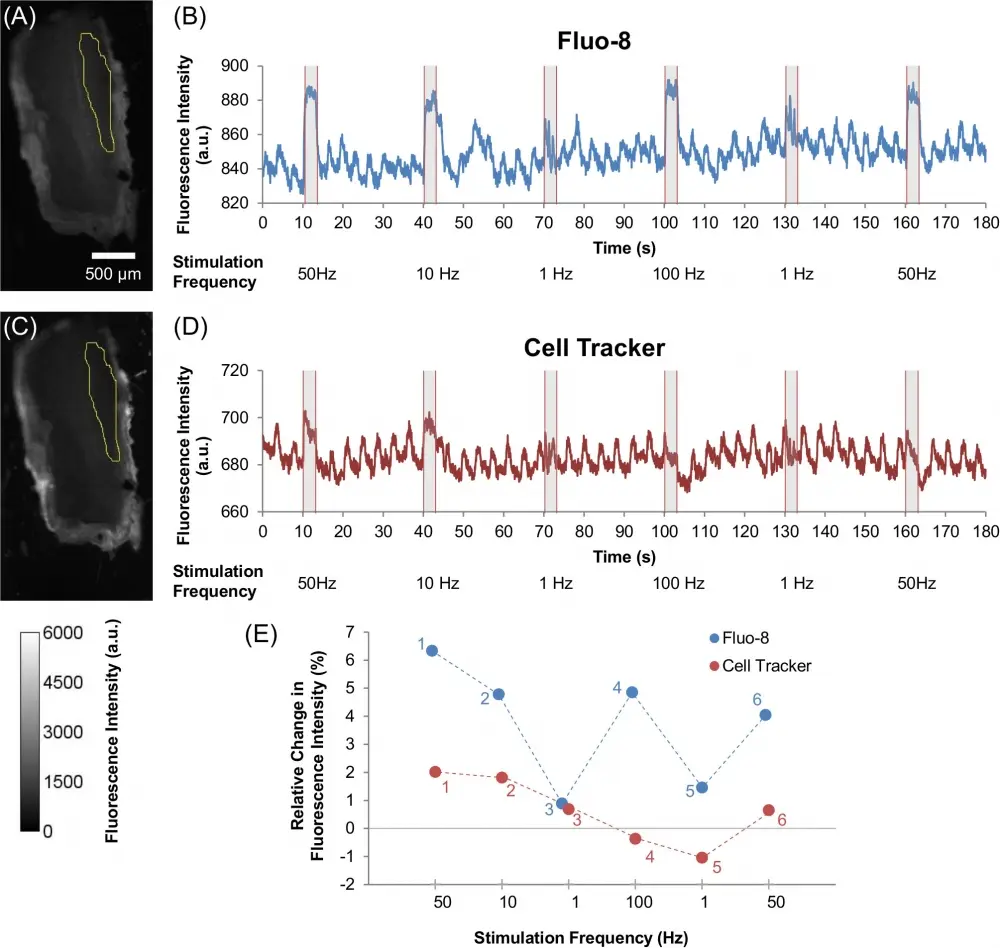
Figura 3. Efecto de varias frecuencias de estimulación eléctrica sobre la dinámica del Ca2+ y el desplazamiento muscular en el músculo de la pata del escarabajo. Imágenes del músculo de la pata del escarabajo que se dosificó con (A) Fluo-8 (60 µM) y (C) Cell Tracker (60 µM), con la selección amarilla que indica el ROI que se usó para el análisis (como también se muestra en S1B Fig. ). La escala de colores se encuentra en la esquina inferior izquierda de la imagen. Cursos de tiempo representativos que muestran la dinámica de intensidad de fluorescencia de (B) Fluo-8 y (D) Cell Tracker bajo varias estimulaciones eléctricas de múltiples trenes de pulso (50 Hz, 10 Hz, 1 Hz, 100 Hz, 1 Hz y 50 Hz; Ciclo de trabajo del 10%; 2 V) observados desde el ROI que se muestran en (A) y (C) respectivamente. Todas las estimulaciones eléctricas se aplicaron durante períodos de 3 segundos con un período de descanso de 27 segundos entre estimulaciones. El momento del estímulo se indica con sombreado gris. (E) Cambio relativo en la intensidad de la fluorescencia ((ΔF/F0)×100 %) para Fluo-8 (azul) y Cell Tracker (rojo) bajo diferentes frecuencias de estimulación eléctrica (50 Hz, 10 Hz, 1 Hz, 100 Hz, 1 Hz y 50 Hz; ciclo de trabajo del 10 %; 2 V). Los pequeños números al lado de cada parcela indican el orden de estimulación; es decir, primero desde 50 Hz seguido de pulsos de frecuencia variable (10 Hz, 1 Hz, 100 Hz, 1 Hz y 50 Hz). El gráfico de intensidad de Fluo-8 muestra que la dinámica de Ca2+ depende de la frecuencia de estimulación eléctrica, mientras que el gráfico de Cell Tracker muestra que el desplazamiento muscular contribuye en pequeña medida. Fuente: Gráfico de dosificación oral de indicadores químicos para el control in vivo de la dinámica de Ca2+ en el músculo de insectos por Ferdinandus et al., PLOS, enero de 2015.
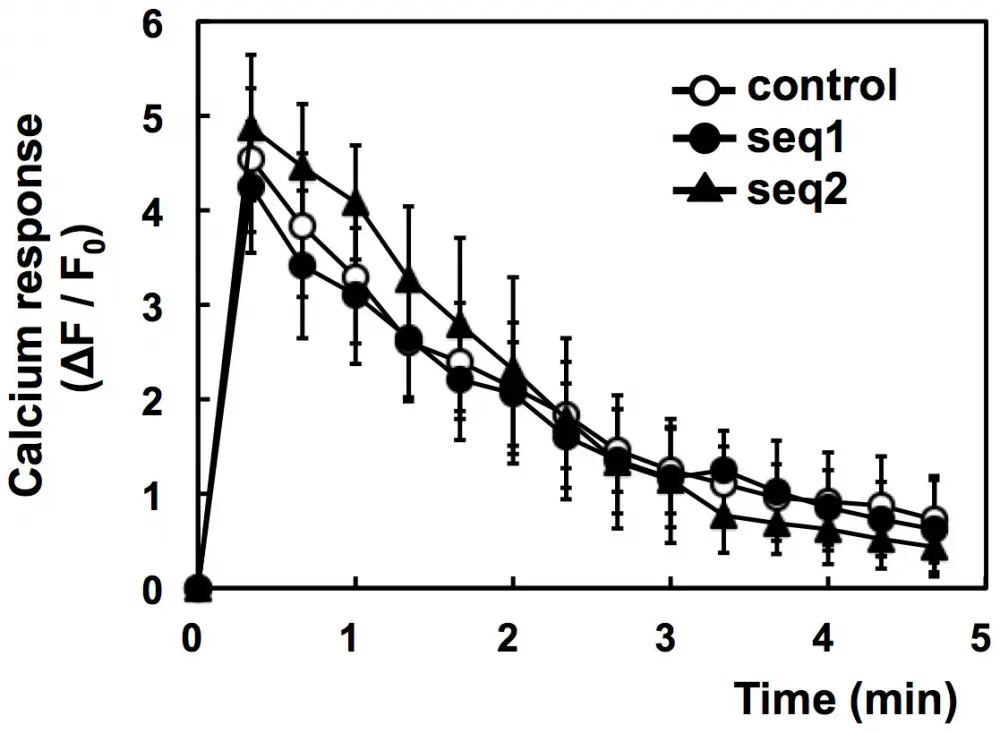
Figura 4. Falla de la eliminación de PI3K-C2α para inhibir la respuesta de calcio inducida por antígeno. Las células sensibilizadas con IgE se incubaron con colorante Fluo-8 a 25 °C durante 20 min. Las células se lavaron y estimularon con DNP-BSA 1 µM a 30°C. Se monitorearon las intensidades de fluorescencia promedio (F) de las células individuales. Los datos se muestran como ΔF/F0, donde F0 es el valor basal de F obtenido como la intensidad promedio de las células individuales y ΔF es la diferencia entre F y F0. Los datos se obtuvieron de tres experimentos separados (se controlaron 24 células en total) y se muestran como la media ± s.d. Fuente: Gráfico de la participación de la fosfoinositida 3-quinasa α-isoforma de clase II en la desgranulación inducida por antígeno en células RBL-2H3 por Kiyomi Nigorikawa et al., PLOS, octubre de 2014.
Ver todas las 29 imagenes
Bibliografía
Ver todas las 352 bibliografías: Citation Explorer
Smooth muscle AKG/OXGR1 signaling regulates epididymal fluid acid-base balance and sperm maturation
Authors: Xu, Chang and Yuan, Yexian and Zhang, Cha and Zhou, Yuchuan and Yang, Jinping and Yi, Huadong and Gyawali, Ishwari and Lu, Jingyi and Guo, Sile and Ji, Yunru and others,
Journal: Life Metabolism (2022)
Geraniol-Mediated Suppression of Endoplasmic Reticulum Stress Protects against Cerebral Ischemia–Reperfusion Injury via the PERK-ATF4-CHOP Pathway
Authors: Wu, Yu and Fan, Xiaomei and Chen, Sha and Deng, Ling and Jiang, Lu and Yang, Shaonan and Dong, Zhi
Journal: International Journal of Molecular Sciences (2022): 544
Involvement of TRPM7 Channel on the Induction of Diabetic Neuropathic Pain in Mice: Protective Role of Selenium and Curcumin
Authors: Ayd{\i}n, B{\”u}nyamin and Naz{\i}ro{\u{g}}lu, Mustafa
Journal: Biological Trace Element Research (2022): 1–19
Neuronal hyperexcitability drives central and peripheral nervous system tumor progression in models of neurofibromatosis-1
Authors: Anastasaki, Corina and Mo, Juan and Chen, Ji-Kang and Chatterjee, Jit and Pan, Yuan and Scheaffer, Suzanne M and Cobb, Olivia and Monje, Michelle and Le, Lu Q and Gutmann, David H
Journal: Nature Communications (2022): 1–17
Single-molecule and super-resolved imaging deciphers membrane behaviour of onco-immunogenic CCR5
Authors: Hunter, Patrick and Payne-Dwyer, Alex L and Shaw, Michael and Signoret, Nathalie and Leake, Mark C
Journal: iScience (2022): 105675
Role of Activin in Synaptic Plasticity of Mouse Hippocampus
Authors: Dahlmanns, Marc
Journal: (2022)
Bioinspired two-in-one nanotransistor sensor for the simultaneous measurements of electrical and mechanical cellular responses
Authors: Gao, Hongyan and Yang, Feiyu and Sattari, Kianoosh and Du, Xian and Fu, Tianda and Fu, Shuai and Liu, Xiaomeng and Lin, Jian and Sun, Yubing and Yao, Jun
Journal: Science advances (2022): eabn2485
Hypothermia evoked by stimulation of medial preoptic nucleus protects the brain in a mouse model of ischaemia
Authors: Zhang, Shuai and Zhang, Xinpei and Zhong, Haolin and Li, Xuanyi and Wu, Yujie and Ju, Jun and Liu, Bo and Zhang, Zhenyu and Yan, Hai and Wang, Yizheng and others,
Journal: Nature Communications (2022): 1–15
Leaf-venation-directed cellular alignment for macroscale cardiac constructs with tissue-like functionalities
Authors: Mao, Mao and Qu, Xiaoli and Zhang, Yabo and Gu, Bingsong and Li, Chen and Liu, Rongzhi and Li, Xiao and Zhu, Hui and He, Jiankang and Li, Dichen
Journal: (2022)
Archetype tasks link intratumoral heterogeneity to plasticity and cancer hallmarks in small cell lung cancer
Authors: Groves, Sarah M and Ildefonso, Geena V and McAtee, Caitlin O and Ozawa, Patricia MM and Ireland, Abbie S and Stauffer, Philip E and Wasdin, Perry T and Huang, Xiaomeng and Qiao, Yi and Lim, Jing Shan and others,
Journal: Cell Systems (2022): 690–710
Referencias
Ver todas las 26 referencias: Citation Explorer
Novel fluo-4 analogs for fluorescent calcium measurements
Authors: Martin VV, Beierlein M, Morgan JL, Rothe A, Gee KR.
Journal: Cell Calcium (2004): 509
Kinetic characterization of novel NR2B antagonists using fluorescence detection of calcium flux
Authors: Bednar B, Cunningham ME, Kiss L, Cheng G, McCauley JA, Liverton NJ, Koblan KS.
Journal: J Neurosci Methods (2004): 247
Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41
Authors: do Ceu Monteiro M, Sansonetty F, Goncalves MJ, O’Connor JE.
Journal: Cytometry (1999): 302
Amplitude distribution of calcium sparks in confocal images: theory and studies with an automatic detection method
Authors: Cheng H, Song LS, Shirokova N, Gonzalez A, Lakatta EG, Rios E, Stern MD.
Journal: Biophys J (1999): 606
A simple numerical model of calcium spark formation and detection in cardiac myocytes
Authors: Smith GD, Keizer JE, Stern MD, Lederer WJ, Cheng H.
Journal: Biophys J (1998): 15
Monitoring calcium in outer hair cells with confocal microscopy and fluorescence ratios of fluo-3 and fura-red
Authors: Su ZL, Li N, Sun YR, Yang J, Wang IM, Jiang SC.
Journal: Shi Yan Sheng Wu Xue Bao (1998): 323
Loading and localization of Fluo-3 and Fluo-3/AM calcium indicators in sinapis alba root tissue
Authors: Tretyn A, Kado RT, Kendrick RE.
Journal: Folia Histochem Cytobiol (1997): 41
Nucleoplasmic and cytoplasmic differences in the fluorescence properties of the calcium indicator Fluo-3
Authors: Perez-Terzic C, Stehno-Bittel L, Clapham DE.
Journal: Cell Calcium (1997): 275
Detection of a trigger zone of bradykinin-induced fast calcium waves in PC12 neurites
Authors: Reber BF, Schindelholz B.
Journal: Pflugers Arch (1996): 893
Improved four-color flow cytometry method using fluo-3 and triple immunofluorescence for analysis of intracellular calcium ion ([Ca2+]i) fluxes among mouse lymph node B- and T-lymphocyte subsets
Authors: Greimers R, Trebak M, Moutschen M, Jacobs N, Boniver J.
Journal: Cytometry (1996): 205
Aplication notes(en Ingles)
A Meta-Analysis of Common Calcium Indicators
Dendritic Calcium Activity Precedes Inspiratory Bursts in pre-Bötzinger Complex Neurons
Fluo-8® Calcium Reagents and Screen Quest™ Fluo-8 NW Calcium Assay Kits
Green Tea Polyphenol Epigallocatechin Gallate Activates TRPA1 in an Intestinal Enteroendocrine Cell Line, STC-1
Implication of Transient Receptor Potential Vanilloid Type 1 in 14,15-Epoxyeicosatrienoic Acid-induced Angiogenesis
AssayWise

