Descripción
Las especies reactivas de oxígeno (ROS) son subproductos naturales del metabolismo normal del oxígeno y juegan un papel importante en la señalización celular. La acumulación de ROS da como resultado un daño significativo a las estructuras celulares. El papel del estrés oxidativo en las enfermedades cardiovasculares, la diabetes, la osteoporosis, los accidentes cerebrovasculares, las enfermedades inflamatorias, una serie de enfermedades neurodegenerativas y el cáncer ha sido bien establecido. La medición de ROS ayudará a determinar cómo el estrés oxidativo modula diversas vías intracelulares.
El kit de ensayo de actividad de ROS total intracelular fluorimétrico Cell Meter™ utiliza nuestro sensor patentado ROS Brite™ 670 para cuantificar ROS en células vivas. El ROS Brite™ 670, permeable a las células y no fluorescente, exhibe una fuerte señal de fluorescencia al reaccionar con ROS. El sensor ROS Brite™ 670 está localizado en el citoplasma. La señal de fluorescencia del sensor ROS Brite™ 670 se puede medir mediante microscopía de fluorescencia, imágenes de alto contenido, fluorometría de microplaca o citometría de flujo.
El kit de ensayo de actividad de ROS total intracelular fluorimétrico Cell Meter™ proporciona un ensayo fluorimétrico sensible de un solo paso para detectar ROS intracelulares (especialmente superóxido y radical hidroxilo) en células vivas dentro de 1 hora de incubación. El ensayo se puede realizar en un conveniente formato de placa de microtitulación de 96 pocillos o de 384 pozos utilizando un lector de microplacas de fluorescencia o un microscopio de fluorescencia con filtro Cy5.
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-22903 | Cell Meter™ Fluorimetric Intracellular Total ROS Activity Assay Kit | 200 ensayos |
Importante: Solo para uso en investigación (RUO).
Plataforma
Lector de Microplacas de Flourescencia
| Excitación | 650 nm |
| Emisión | 675 nm |
| Corte | 665 nm |
| Placa Recomendada | Paredes negras / fondo claro |
| Especificaciones Instrumento | Modo de lectura inferior |
Citómetro de flujo
| Excitación Laser | 640 nm |
| Emisión Filtro | 660/20 nm |
| Especificaciones Instrumento | Canal APC |
Microscopio de Flourescencia
| Excitación | Juego de Filtros Cy5 |
| Emisión | Juego de Filtros Cy5 |
| Especificaciones Instrumento | Paredes negras / fondo claro |
Componentes
| Componente A: ROS Brite™ 670 | 1 vial |
| Componente B: Buffer de ensayo | 1 botella (20ml) |
| Componente C: DMSO | 1 vial (100 µL) |
Preparación de Solución de Stock
A menos que se indique lo contrario, todas las soluciones madre no utilizadas deben dividirse en alícuotas de un solo uso y almacenarse a -20 °C después de la preparación. Evite los ciclos repetidos de congelación y descongelación.
Solución madre ROS Brite™ 670 (500X)
Agregue 40 µL de DMSO (Componente C) en el vial de ROS Brite™ 670 (Componente A) y mezcle bien para preparar una solución madre de 500X ROS Brite™ 670. Proteger de la luz.
Nota: Tenga en cuenta que 20 µL de solución madre 500X ROS Brite™ 670 es suficiente para 1 placa. Para el citómetro de flujo y para mayor comodidad, la solución madre 500X ROS Brite™ 670 se puede diluir por 5 a 100X en DMSO. Para el almacenamiento, selle los tubos herméticamente.
Preparación de Solución de Trabajo
Agregue 20 µl de solución madre 500X ROS Brite™ 670 en 10 ml de buffer de ensayo (componente B) y mezcle bien para preparar la solución de trabajo ROS Brite™ 670.
Nota: Esta solución de trabajo ROS Brite™ 670 es estable durante al menos 2 horas a temperatura ambiente.
Preparación de células
Para guias sobre la preparación de muestras de células, visite https://www.aatbio.com/resources/guides/cell-sample-preparation.html
Imagenes

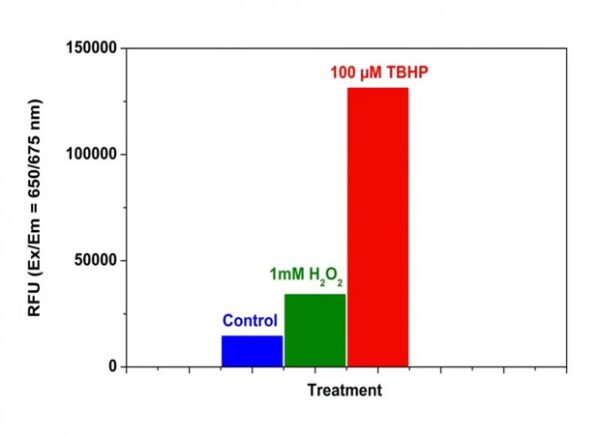
Figura 1. Detección de ROS en células HeLa con el kit de ensayo de actividad de ROS total intracelular fluorimétrico Cell Meter™. Se sembraron 15.000 células HeLa durante la noche con /90 µl pozo en una placa de 96 pocillos Costar de pared negra/fondo transparente. Las células control no se trataron o se trataron con 100 µM H2O2 a 1 mM o hidroperóxido de terc-butilo (TBHP) durante 30 minutos a 37 °C. Se añadió la solución de trabajo ROS Brite™ 670 (100 µl/ pozo) y se incubó en una incubadora a 37 °C con CO2 al 5 % durante 1 hora. La señal de fluorescencia se controló a Ex/Em = 650/675 nm (corte = 665 nm) con el modo de lectura inferior utilizando FlexStation (Molecular Devices).
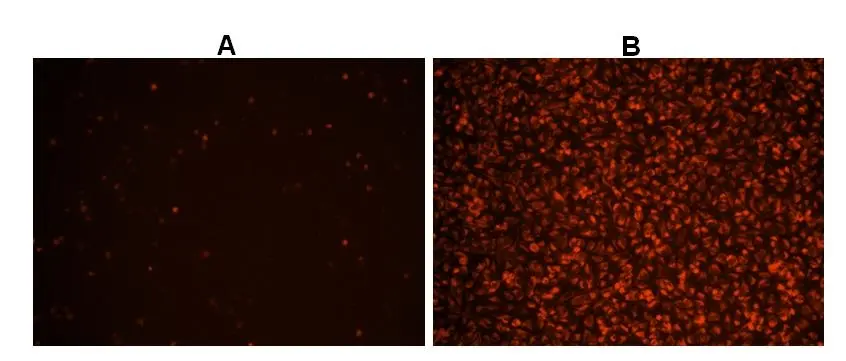
Figura 2. Imágenes de células Hela teñidas con el kit de ensayo de actividad de ROS total intracelular fluorimétrico Cell Meter™ en una placa de 96 pocillos de pared negra/fondo transparente Costar. A: Células control no tratadas. B: Células tratadas con 100 µM de hidroperóxido de terc-butilo (TBHP) durante 30 minutos antes de la tinción.
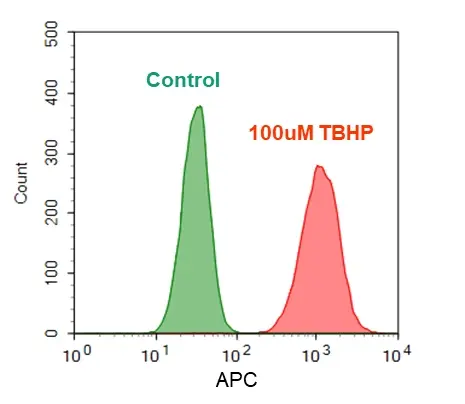
Figura 3. Detección de ROS en células Jurkat. Las células Jurkat se trataron sin (verde) o con 100 µM hidroperóxido de terc-butilo (TBHP) (rojo) durante 30 minutos a 37 °C y luego se cargaron con ROS Brite™ 670 en una incubadora CO2 al 5 %, a 37 °C durante 1 hora. Las intensidades de fluorescencia se midieron con el canal APC utilizando un citómetro de flujo (NovoCyte 3000, ACEA).
Formatos Alternativos
Productos Relacionados
Bibliografía
Ver todas las 21 bibliografías: Citation Explorer
Obstructive sleep apnea-increased DEC1 regulates systemic inflammation and oxidative stress that promotes development of pulmonary arterial hypertension
Authors: Li, Xiaoming and Zhang, Xiang and Hou, Xiaozhi and Bing, Xin and Zhu, Fangyuan and Wu, Xinhao and Guo, Na and Zhao, Hui and Xu, Fenglei and Xia, Ming
Journal: Apoptosis (2022): 1–15
ONC206 has anti-tumorigenic effects in human ovarian cancer cells and in a transgenic mouse model of high-grade serous ovarian cancer
Authors: Tucker, Katherine and Yin, Yajie and Staley, Stuart-Allison and Zhao, Ziyi and Fang, Ziwei and Fan, Yali and Zhang, Xin and Suo, Hongyan and Sun, Wenchuan and Prabhu, Varun Vijay and others,
Journal: American Journal of Cancer Research (2022): 521
Reversal of multidrug resistance by Fissistigma latifolium–derived chalconoid 2-hydroxy-4, 5, 6-trimethoxydihydrochalcone in cancer cell lines overexpressing human P-glycoprotein
Authors: Teng, Yu-Ning and Hung, Chin-Chuan and Kao, Pei-Heng and Chang, Ying-Tzu and Lan, Yu-Hsuan
Journal: Biomedicine \& Pharmacotherapy (2022): 113832
Bcl-2 interacting protein 3 (BNIP3) promotes tumor growth in breast cancer under hypoxic conditions through an autophagy-dependent pathway
Authors: Zhang, Guipu and Xu, Zhiyi and Yu, Minjing and Gao, Haiyan
Journal: Bioengineered (2022): 6280–6292
The Abnormal Proliferation of Hepatocytes is Associated with MC-LR and C-Terminal Truncated HBX Synergistic Disturbance of the Redox Balance
Authors: Cai, Dong-Mei and Mei, Fan-Biao and Zhang, Chao-Jun and An, San-Chun and Lv, Rui-Bo and Ren, Guan-Hua and Xiao, Chan-Chan and Long, Long and Huang, Tian-Ren and Deng, Wei
Journal: Journal of Hepatocellular Carcinoma (2022): 1229–1246
Host Defense against Klebsiella pneumoniae Pneumonia Is Augmented by Lung-Derived Mesenchymal Stem Cells
Authors: Rangasamy, Tirumalai and Ghimire, Laxman and Jin, Liliang and Le, John and Periasamy, Sivakumar and Paudel, Sagar and Cai, Shanshan and Jeyaseelan, Samithamby
Journal: The Journal of Immunology (2021): 1112–1127
Low-power STED nanoscopy based on temporal and spatial modulation
Authors: Wang, Luwei and Chen, Yue and Guo, Yong and Xie, Weixin and Yang, Zhigang and Weng, Xiaoyu and Yan, Wei and Qu, Junle
Journal: Nano Research (2021): 1–8
Hypoxically cultured cells of oral squamous cell carcinoma increased their glucose metabolic activity under normoxic conditions
Authors: Shinohara, Yuta and Washio, Jumpei and Kobayashi, Yuri and Abiko, Yuki and Sasaki, Keiichi and Takahashi, Nobuhiro
Journal: Plos one (2021): e0254966
Tyrosine kinase inhibitor conjugated quantum dots for non-small cell lung cancer (NSCLC) treatment
Authors: Kulkarni, Nishant S and Parvathaneni, Vineela and Shukla, Snehal K and Barasa, Leonard and Perron, Jeanette C and Yoganathan, Sabesan and Muth, Aaron and Gupta, Vivek
Journal: European Journal of Pharmaceutical Sciences (2019)
Anti-proliferation effect of blue light-emitting diodes against antibiotic-resistant Helicobacter pylori
Authors: Ma, Jianwei and Hiratsuka, Takahiro and Etoh, Tsuyoshi and Akada, Junko and Fujishima, Hajime and Shiraishi, Norio and Yamaoka, Yoshio and Inomata, Masafumi
Journal: Journal of Gastroenterology and Hepatology (2018): 1492–1499
Referencias
Automatic flow injection based methodologies for determination of scavenging capacity against biologically relevant reactive species of oxygen and nitrogen
Authors: Magalhaes LM, Lucio M, Segundo MA, Reis S, Lima JL.
Journal: Talanta (2009): 1219
Diabetes and the impairment of reproductive function: possible role of mitochondria and reactive oxygen species
Authors: Amaral S, Oliveira PJ, Ramalho-Santos J.
Journal: Curr Diabetes Rev (2008): 46
Virion disruption by ozone-mediated reactive oxygen species
Authors: Murray BK, Ohmine S, Tomer DP, Jensen KJ, Johnson FB, Kirsi JJ, Robison RA, O’Neill KL.
Journal: J Virol Methods (2008): 74
The role of mitochondria in reactive oxygen species metabolism and signaling
Authors: Starkov AA., undefined
Journal: Ann N Y Acad Sci (2008): 37
Sensitive determination of reactive oxygen species by chemiluminescence methods and their application to biological samples and health foods
Authors: Wada M., undefined
Journal: Yakugaku Zasshi (2008): 1031
Reactive oxygen species and yeast apoptosis
Authors: Perrone GG, Tan SX, Dawes IW.
Journal: Biochim Biophys Acta (2008): 1354
Measurement of reactive oxygen species in cells and mitochondria
Authors: Armstrong JS, Whiteman M.
Journal: Methods Cell Biol (2007): 355
Role of reactive oxygen species in mediating hepatic ischemia-reperfusion injury and its therapeutic applications in liver transplantation
Authors: Zhang W, Wang M, Xie HY, Zhou L, Meng XQ, Shi J, Zheng S.
Journal: Transplant Proc (2007): 1332
Superoxide and derived reactive oxygen species in the regulation of hypoxia-inducible factors
Authors: Gorlach A, Kietzmann T.
Journal: Methods Enzymol (2007): 421
Reactive oxygen species and superoxide dismutases: role in joint diseases
Authors: Afonso V, Champy R, Mitrovic D, Collin P, Lomri A.
Journal: Joint Bone Spine (2007): 324
Application notes (en Ingles)
A Novel Fluorescent Probe for Imaging and Detecting Hydroxyl Radical in Living Cells
A Novel Fluorescent Probe for Imaging and Detecting Hydroxyl Radical in Living Cells
A Comparison of Fluorescent Red Calcium Indicators for Detecting Intracellular Calcium Mobilization in CHO Cells
A Meta-Analysis of Common Calcium Indicators
A New Red Fluorescent & Robust Screen Quest™ Rhod-4™ Ca2+Indicator for Screening GPCR & Ca2+ Channel Targets