Kit de ensayo de Flujo de calcio intracelular Mod. Calbryte™ 520 AM. Este es un método ampliamente utilizado para monitorear las vías de transducción de señales y la detección de alto rendimiento de receptores acoplados a proteína G (GPCR) y objetivos de canales de calcio.
Descripción
El ensayo de flujo de calcio intracelular es un método ampliamente utilizado para monitorear las vías de transducción de señales y la detección de alto rendimiento de receptores acoplados a proteína G (GPCR) y objetivos de canales de calcio. Seguido por Fluo-3 que se introdujo en 1989, Fluo-4, Fluo-8 y Cal-520 se desarrollaron más tarde con una relación señal/fondo mejorado y se convirtieron en los indicadores de Ca2+ ampliamente utilizados para microscopía confocal, citometría de flujo y aplicaciones de detección de alto rendimiento. Sin embargo, todavía hay algunos problemas graves con Fluo-4. Por ejemplo, En cuanto a Fluo-3, en la mayoría de los ensayos de calcio intracelular con Fluo-4 AM, se requiere probenecid para evitar que el Fluo-4 cargado en las células se escape de las células. compromete los resultados del ensayo ya que está bien documentado que el probenecid tiene una variedad de efectos celulares complicados. Calbryte™ 520, AM es un nuevo indicador fluorescente y permeable a las células para la medición del calcio intracelular Al igual que otros colorantes esteres AM, Calbryte™ 520 AM no es fluorescente ni activable.
Una vez que Calbryte™ 520 AM ingresa a la célula, es fácilmente hidrolizado por la esterasa intracelular donde se activa y responde al calcio. El indicador activado ahora es una molécula polar que es incapaz de difundirse libremente a través de la membrana celular, esencialmente atrapándolo dentro de la célula. Al unirse a los iones de calcio, Calbryte™ 520 produce una señal de fluorescencia brillante con una relación señal/fondo extremadamente alta. Tiene la misma longitud de onda de excitación y emisión que Fluo-4, por lo que la misma configuración de ensayo de Fluo-4 se puede aplicar fácilmente a los ensayos de calcio basados en Calbryte™ 520. Su relación señal/fondo muy mejorada y sus propiedades de retención intracelular hacen de Calbryte™ 520 AM el indicador más robusto para evaluar los objetivos de los canales de calcio y GPCR, así como para detectar sus agonistas y antagonistas en células vivas.
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-20650 | Calbryte™ 520 AM | 2 x 50 ug |
| AAT-20651 | Calbryte™ 520 AM | 10 x 50 ug |
| AAT-20653 | Calbryte™ 520 AM | 1 mg |
Importante: Solo para uso en investigación (RUO). Almacenamiento: Congelar a (< -15 °C), Minimizar la exposición a la luz.
Plataforma
Lector de Microplacas de Flourescencia
| Excitación | 490 nm |
| Emisión | 252 nm |
| Corte | 515 nm |
| Placa Recomendada | Paredes negras / fondo claro |
| Especificaciones Instrumento | Modo de lectura inferior / Manejo de líquidos programable |
Citómetro de flujo
| Laser de Excitación | 488 nm |
| Filtro de Emisión | 530/30 nm |
| Especificaciones instrumento | Canal FITC |
Microscopio de Flourescencia
| Excitación | FITC |
| Emisión | FITC |
| Placa recomendada | Paredes negras / fondo claro |
Espectro
Abrir en Advanced Spectrum Viewer
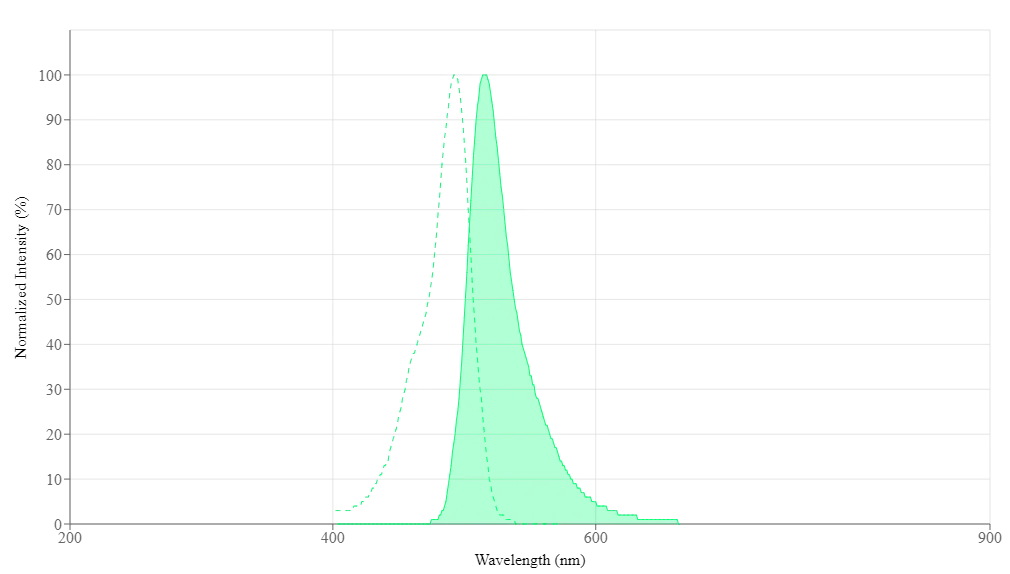
Propiedades espectrales
| Excitación (nm) | 493 |
| Emisión (nm) | 515 |
| Rendimiento cuántico | 0.751 |
PREPARACION DE SOLUCIONES DE STOCK
A menos que se indique lo contrario, todas las soluciones madre no utilizadas deben dividirse en alícuotas de un solo uso y almacenarse a -20 °C después de la preparación. Evite los ciclos repetidos de congelación y descongelación.
Solución madre Calbryte™ 520 AM
Prepare una solución madre de 2 a 5 mM de Calbryte™ 520 AM en DMSO anhidro.
PREPARACION DE SOLUCIONES DE TRABAJO
Solución de trabajo Calbryte™ 520 AM
El día del experimento, disuelva Calbryte™ 520 AM en DMSO o descongele una alícuota de la solución madre indicadora a temperatura ambiente. Prepare una solución de trabajo de tinte de 2 a 20 µM en un buffer de su elección (p. ej., Hanks y Hepes) con Pluronic® F-127 al 0,04 %. Para la mayoría de las líneas celulares, se recomienda Calbryte™ 520 AM a una concentración final de 4 a 5 μM. La concentración exacta de indicadores necesarios para la carga de células debe determinarse empíricamente.
Nota: El detergente no iónico Pluronic® F-127 a veces se usa para aumentar la solubilidad acuosa de Calbryte™ 520 AM. Se puede comprar una variedad de soluciones Pluronic® F-127 de AAT Bioquest.
Nota: Si sus células contienen transportadores de aniones orgánicos, se puede agregar probenecid (1-2 mM) a la solución de trabajo del colorante (la concentración final en el pocillo será de 0,5-1 mM) para reducir la fuga de los indicadores desesterificados. Se puede comprar una variedad de productos de probenecid ReadiUse™, que incluyen sal de sodio soluble en agua y solución estabilizada, en AAT Bioquest.
Calculadora
Preparación de la solución de stock común
Volumen de DMSO necesario para reconstituir la masa específica de Calbryte™ 520 AM a la concentración dada. Tenga en cuenta que el volumen es solo para preparar la solución madre. Consulte el protocolo experimental de muestra para conocer los buffers experimentales/fisiológicos apropiados.
| 0.1 mg | 0.5 mg | 1 mg | 5 mg | 10 mg | |
| 1 mM | 91.667 µL | 458.337 µL | 916.674 µL | 4.583 mL | 9.167 mL |
| 5 mM | 18.333 µL | 91.667 µL | 183.335 µL | 916.674 µL | 1.833 mL |
| 10 mM | 9.167 µL | 45.834 µL | 91.667 µL | 458.337 µL | 916.674 µL |
Imagenes
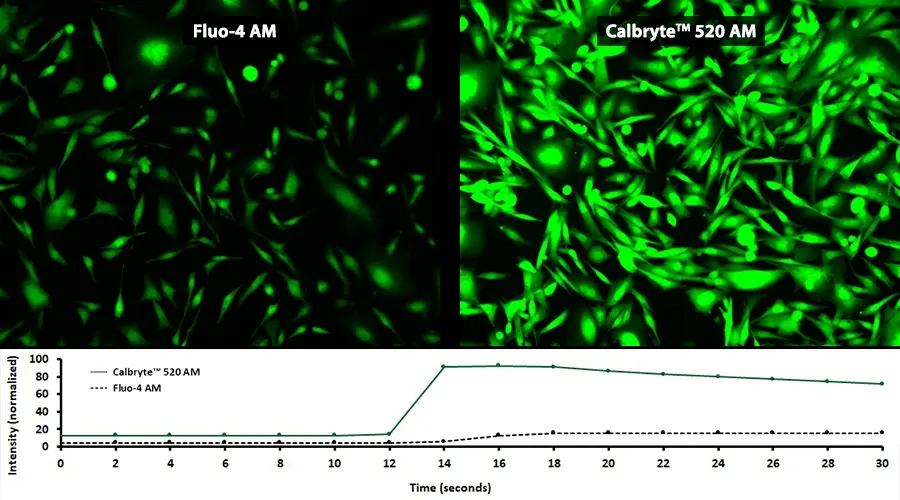
Figura 1. La respuesta de ATP se midió en células CHO-K1 usando Calbryte™ 520 AM (Cat No. 20653) y Fluo-4, AM (Cat No. 20550). Se sembraron células CHO-K1 50.000 células/100 µl/pozo durante la noche a en una placa costar de 96 pocillos de pared negra/fondo transparente. Se añadieron a los pozos 100 µl de 10 µg/ml de Calbryte™ 520 AM en buffer HH con probenecid o 10 µg/ml de Fluo-4, AM en buffer HH con probenecid y se incubaron durante 45 minutos a 37 °C. Ambas soluciones de carga de tinte se eliminaron y se reemplazaron con 200 µl de buffer HH/pocillo. Se añadió ATP (50 µl/pocillo) para lograr la concentración final indicada de 10 µM. Las imágenes fueron adquiridas en un microscopio Keyence en el canal FITC.

Figura 2. La respuesta a la dosis de carbacol se midió en células CHO-M1 con Calbryte™ 520 AM y Fluo-4 AM. Se sembraron células CHO-M1 durante la noche a 50.000 células/100 µl/pocillo en una placa costar de 96 pocillos de pared negra/fondo transparente. Se añadieron 100 µl de 10 µg/ml de Calbryte™ 520 AM en buffer HH o 10 µg/ml de Fluo-4 en buffer HH y se incubaron durante 45 minutos a 37 °C. A continuación, la solución de carga de tinte se eliminó y se reemplazó con 200 µl de buffer HH/pocillo. FlexStation 3 añadió carbacol (50 µl/pocillo) para alcanzar las concentraciones finales indicadas.
Formatos Alternativos
Productos Relacionados
| Nombre | Excitation (nm) | Emission (nm) | Quantum yield |
| Calbryte™ 590 AM | 581 | 593 | – |
| Calbryte™ 630 AM | 607 | 624 | – |
| Calbryte™-520L AM | 493 | 515 | 0.751 |
| Calbryte™-520XL AM | 493 | 515 | 0.751 |
| Cal-520®, AM | 493 | 515 | 0.751 |
| Mag-520™ AM | 506 | 525 | – |
Bibliografía
Ver todas las 166 bibliografias: Citation Explorer
The influence of spontaneous and visual activity on the development of direction selectivity maps in mouse retina
Authors: Tiriac, Alexandre and Bistrong, Karina and Pitcher, Miah N and Tworig, Joshua M and Feller, Marla B
Journal: Cell reports (2022): 110225
Temporal signals drive the emergence of multicellular information networks
Authors: Li, Guanyu and LeFebre, Ryan and Starman, Alia and Chappell, Patrick and Mugler, Andrew and Sun, Bo
Journal: arXiv preprint arXiv:2202.13462 (2022)
Downregulated Calcium-Binding Protein S100A16 and HSP27 in Placenta-Derived Multipotent Cells Induce Functional Astrocyte Differentiation
Authors: Cheng, Yu-Che and Huang, Chi-Jung and Ku, Wei-Chi and Guo, Shu-Lin and Tien, Lu-Tai and Lee, Yih-Jing and Chien, Chih-Cheng
Journal: Stem Cell Reviews and Reports (2022): 1–14
iRhom pseudoproteases regulate ER stress-induced cell death through IP3 receptors and BCL-2
Authors: Dulloo, Iqbal and Atakpa-Adaji, Peace and Yeh, Yi-Chun and Levet, Cl{\’e}mence and Muliyil, Sonia and Lu, Fangfang and Taylor, Colin W and Freeman, Matthew
Journal: Nature Communications (2022): 1–18
pH-Dependence of Glucose-Dependent Activity of Beta Cell Networks in Acute Mouse Pancreatic Tissue Slice
Authors: Postic, S and Gosak, M and Tsai, WH and Pfabe, J and Sarikas, S and Stozˇer, A and Korosˇak, D and Yang, SB and Slak Rupnik, M
Journal: Front. Endocrinol. 13: 916688. doi: 10.3389/fendo (2022)
CPVT-associated calmodulin variants N53I and A102V dysregulate Ca2+ signalling via different mechanisms
Authors: Prakash, Ohm and Held, Marie and McCormick, Liam F and Gupta, Nitika and Lian, Lu-Yun and Antonyuk, Svetlana and Haynes, Lee P and Thomas, N Lowri and Helassa, Nordine
Journal: Journal of Cell Science (2022): jcs258796
Engineered Extracellular Matrices with Integrated Wireless Microactuators to Study Mechanobiology
Authors: Uslu, Fazil E and Davidson, Christopher D and Mailand, Erik and Bouklas, Nikolaos and Baker, Brendon M and Sakar, Mahmut Selman
Journal: Advanced Materials (2021): 2102641
Pharmic Activation of PKG2 Alleviates Diabetes-Induced Osteoblast Dysfunction by Suppressing PLC$\beta$1-Ca2+-Mediated Endoplasmic Reticulum Stress
Authors: Jia, Tingting and Wang, Ya-nan and Feng, Yao and Wang, Chenchen and Zhang, Dongjiao and Xu, Xin
Journal: Oxidative Medicine and Cellular Longevity (2021)
Mechanistic Investigation of Cell Cryopreservation Aided by Raman Spectroscopy: Challenges and Solutions for hiPSC Technologies
Authors: Li, Rui
Journal: (2021)
NMDA receptor inhibition increases, synchronizes, and stabilizes the collective pancreatic beta cell activity: Insights through multilayer network analysis
Authors: {\v{S}}terk, Marko and Kri{\v{z}}an{\v{c}}i{\’c} Bombek, Lidija and Skelin Klemen, Ma{\v{s}}a and Slak Rupnik, Marjan and Marhl, Marko and Sto{\v{z}}er, Andra{\v{z}} and Gosak, Marko
Journal: PLoS Computational Biology (2021): e1009002
Referencias
Ver todas las 63 referencias: Citation Explorer
Calreticulin regulates TGF-β1-induced epithelial mesenchymal transition through modulating Smad signaling and calcium signaling
Authors: Wu, Yanjiao and Xu, Xiaoli and Ma, Lunkun and Yi, Qian and Sun, Weichao and Tang, Liling
Journal: The International Journal of Biochemistry & Cell Biology (2017)
Monosialoganglioside 1 may alleviate neurotoxicity induced by propofol combined with remifentanil in neural stem cells
Authors: Lu, Jiang and Yao, Xue-qin and Luo, Xin and Wang, Yu and Chung, Sookja Kim and Tang, He-xin and Cheung, Chi Wai and Wang, Xian-yu and Meng, Chen and Li, Qing and others, undefined
Journal: Neural Regeneration Research (2017): 945
Obtaining spontaneously beating cardiomyocyte-like cells from adipose-derived stromal vascular fractions cultured on enzyme-crosslinked gelatin hydrogels
Authors: Yang, Gang and Xiao, Zhenghua and Ren, Xiaomei and Long, Haiyan and Ma, Kunlong and Qian, Hong and Guo, Yingqiang
Journal: Scientific Reports (2017): 41781
Dexmedetomidine reduces hypoxia/reoxygenation injury by regulating mitochondrial fission in rat hippocampal neurons
Authors: Liu, Jia and Du, Qing and Zhu, He and Li, Yu and Liu, Maodong and Yu, Shoushui and Wang, Shilei
Journal: Int J Clin Exp Med (2017): 6861–6868
Di (2-ethylhexyl) phthalate-induced apoptosis in rat INS-1 cells is dependent on activation of endoplasmic reticulum stress and suppression of antioxidant protection
Authors: Sun, Xia and Lin, Yi and Huang, Qiansheng and Shi, Junpeng and Qiu, Ling and Kang, Mei and Chen, Yajie and Fang, Chao and Ye, Ting and Dong, Sijun
Journal: Journal of cellular and molecular medicine (2015): 581–594
The effect of mitochondrial calcium uniporter on mitochondrial fission in hippocampus cells ischemia/reperfusion injury
Authors: Zhao, Lantao and Li, Shuhong and Wang, Shilei and Yu, Ning and Liu, Jia
Journal: Biochemical and biophysical research communications (2015): 537–542
Role of mitochondrial calcium uniporter in regulating mitochondrial fission in the cerebral cortexes of living rats
Authors: Liang, Nan and Wang, Peng and Wang, Shilei and Li, Shuhong and Li, Yu and Wang, Jinying and Wang, Min
Journal: Journal of Neural Transmission (2014): 593–600
Propofol and remifentanil at moderate and high concentrations affect proliferation and differentiation of neural stem/progenitor cells
Authors: Li, Qing and Lu, Jiang and Wang, Xianyu and others, undefined
Journal: Neural regeneration research (2014): 2002
Fungus induces the release of IL-8 in human corneal epithelial cells, via Dectin-1-mediated protein kinase C pathways.
Authors: Peng, Xu-Dong and Zhao, Gui-Qiu and Lin, Jing and Jiang, Nan and Xu, Qiang and Zhu, Cheng-Cheng and Qu, Jain-Qiu and Cong, Lin and Li, Hui
Journal: International journal of ophthalmology (2014): 441–447
Increased expression of cell adhesion molecule 1 by mast cells as a cause of enhanced nerve–mast cell interaction in a hapten-induced mouse model of atopic dermatitis
Authors: Hagiyama, M and Inoue, T and Furuno, T and Iino, T and Itami, S and Nakanishi, M and Asada, H and Hosokawa, Y and Ito, A
Journal: British Journal of Dermatology (2013): 771–778
Aplication Notes (en Ingles)
Calbryte™ 520, Calbryte™ 590 and Calbryte™ 630 Calcium Detection Reagents
Introducing Calbryte™ Series
The Eight Best Green Fluorescent Calcium Indicators
What’s A Ratiometric Indicator
Calbryte™ 520, Calbryte™ 590 and Calbryte™ 630 Calcium Detection Reagents


