iFluor® 555 SE es razonablemente estable y muestra buena reactividad y selectividad con los grupos amino de proteínas.
Descripción
Los tintes iFluor® de AAT Bioquest están optimizados para marcar proteínas, en particular anticuerpos. Estos tintes son brillantes, fotoestables y tienen un enfriamiento mínimo de las proteínas. Pueden excitarse bien con las principales líneas láser de los instrumentos de fluorescencia (p. ej., 350, 405, 488, 555 y 633 nm). Los colorantes iFluor® 555 tienen un máximo de excitación y emisión de fluorescencia de ~557 nm y ~570 nm respectivamente. La familia iFluor® 555 tiene propiedades espectrales esencialmente idénticas a las de Cy3® (Cy3® es una marca comercial de GE Healthcare).
En comparación con las sondas Cy3, los reactivos iFluor® 555 tienen una fluorescencia mucho más fuerte y una mayor fotoestabilidad. Su fluorescencia es independiente del pH entre pH 3 y 11. Estas características espectrales hacen de esta nueva familia de colorantes una alternativa superior a Cy3®. La familia iFluor® 555 se ha convertido en un excelente reemplazo para el colorante de etiquetado Cy3® y Alexa Fluor® 555 (Cy3® y Alexa Fluor® son marcas comerciales de Invitrogen y GE Health Care).
iFluor® 555 SE es razonablemente estable y muestra buena reactividad y selectividad con los grupos amino de proteínas.
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-1028 | iFluor® 555 succinimidyl ester | 1mg |
| AAT-71028 | iFluor® 555 succinimidyl ester | 100 ug |
| AAT-71507 | iFluor® 555 succinimidyl ester | 5mg |
| AAT-71557 | iFluor® 555 succinimidyl ester | 10mg |
Importante: Solo para uso en investigación (RUO). Almacenamiento: Congelación (< -15 °C). Minimizar la exposición a la luz.
Propiedades fisicas
| Peso Molecular | 1125.26 |
| Disolvente | DMSO |
Espectro
Abrir en Advanced Spectrum Viewer

Propiedades espectrales
| Factor de corrección (260 nm) | 0.23 |
| Factor de corrección (280 nm) | 0.14 |
| Coeficiente de extinción (cm -1 M -1) | 1000001 |
| Excitación (nm) | 557 |
| Emisión (nm) | 570 |
| Rendimiento cuántico | 0.641 |
Calculadora
Preparación de la solución de stock común
Volumen de DMSO necesario para reconstituir la masa específica de succinimidil éster iFluor® 555 a la concentración dada. Tenga en cuenta que el volumen es solo para preparar la solución madre. Consulte el protocolo experimental de muestra para conocer los buffers experimentales/fisiológicos apropiados.
| 0.1 mg | 0.5 mg | 1 mg | 5 mg | 10 mg | |
| 1 mM | 88.868 µL | 444.342 µL | 888.684 µL | 4.443 mL | 8.887 mL |
| 5 mM | 17.774 µL | 88.868 µL | 177.737 µL | 888.684 µL | 1.777 mL |
| 10 mM | 8.887 µL | 44.434 µL | 88.868 µL | 444.342 µL | 888.684 µL |
Imagenes

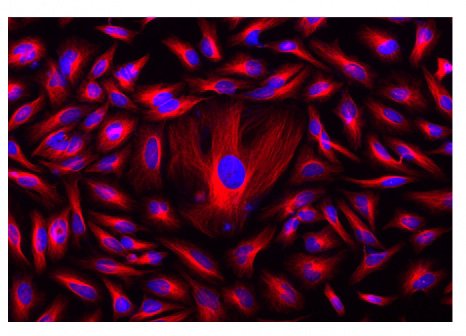
Figura 1. Las células HeLa se incubaron con antitubulina de ratón seguida de conjugado de IgG anti-ratón de cabra iFluorTM 555 de AAT (rojo, derecha) o IgG anti-ratón de cabra conjugado con Alexa Fluor® 555 (rojo, izquierda), respectivamente. Los núcleos celulares se tiñeron con Hoechst 33342 (Blue, Cat# 17530).
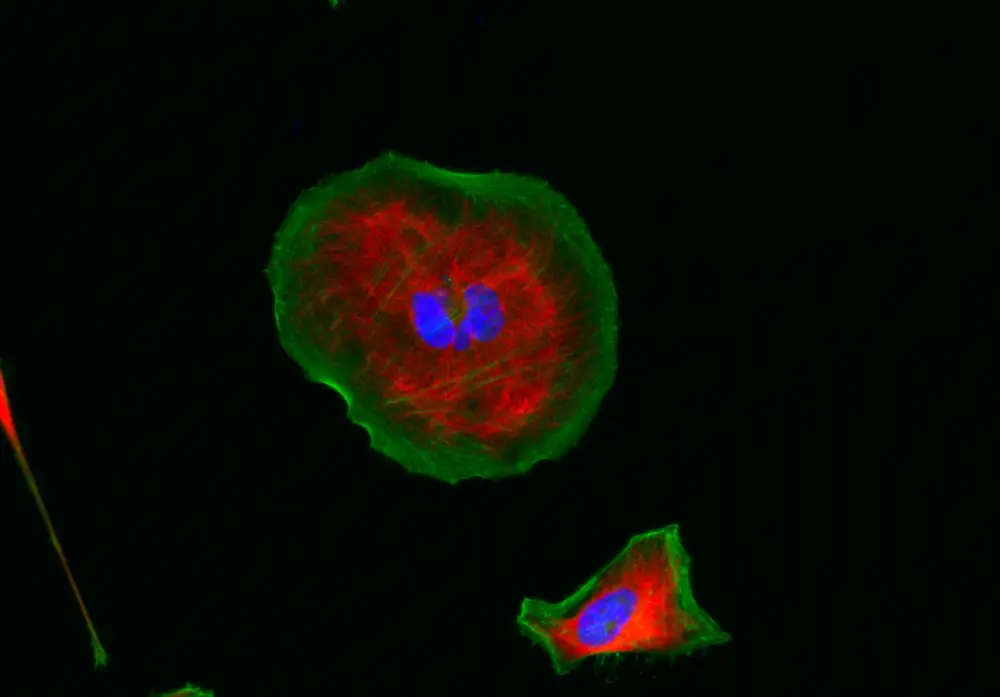
Figura 2. Las células HeLa se tiñeron con antitubulina de ratón seguido de iFluorTM 555 de cabra anti-IgG de ratón (H+L) (rojo); los filamentos de actina se tiñeron con conjugado Phalloidin-iFluorTM 488 (verde); y los núcleos se tiñeron con DAPI (azul).
Productos Similares
| Name | Excitation (nm) | Emission (nm) | Extinction coefficient (cm -1 M -1) | Quantum yield | Correction Factor (260 nm) | Correction Factor (280 nm) |
| iFluor® 350 succinimidyl ester | 345 | 450 | 200001 | 0.951 | 0.83 | 0.23 |
| iFluor® 405 succinimidyl ester | 403 | 427 | 370001 | 0.911 | 0.48 | 0.77 |
| iFluor® 514 succinimidyl ester | 511 | 527 | 750001 | 0.831 | 0.265 | 0.116 |
| iFluor® 532 succinimidyl ester | 537 | 560 | 900001 | 0.681 | 0.26 | 0.16 |
| iFluor® 555 succinimidyl ester | 557 | 570 | 1000001 | 0.641 | 0.23 | 0.14 |
| iFluor® 594 succinimidyl ester | 588 | 604 | 1800001 | 0.531 | 0.05 | 0.04 |
| iFluor® 633 succinimidyl ester | 640 | 654 | 2500001 | 0.291 | 0.062 | 0.044 |
| iFluor® 647 succinimidyl ester | 656 | 670 | 2500001 | 0.251 | 0.03 | 0.03 |
| iFluor® 660 succinimidyl ester | 663 | 678 | 2500001 | 0.261 | 0.07 | 0.08 |
Bibliografías
Rapid and Effective Generation of Nanobody Based CARs using PCR and Gibson Assembly
Authors: De Munter, Stijn and Van Parys, Alexander and Bral, Layla and Ingels, Joline and Goetgeluk, Glenn and Bonte, Sarah and Pille, Melissa and Billiet, Lore and Weening, Karin and Verhee, Annick and others,
Journal: International journal of molecular sciences (2020): 883
Deep Sequencing Analysis of the Eha-Regulated Transcriptome of Edwardsiella tarda Following Acidification
Authors: Gao, D and Liu, N and Li, Y and Zhang, Y and Liu, G and others, undefined
Journal: Metabolomics (Los Angel) (2017): 2153–0769
Suramin inhibits cullin-RING E3 ubiquitin ligases
Authors: Wu, Kenneth and Chong, Robert A and Yu, Qing and Bai, Jin and Spratt, Donald E and Ching, Kevin and Lee, Chan and Miao, Haibin and Tappin, Inger and Hurwitz, Jerard and others, undefined
Journal: Proceedings of the National Academy of Sciences (2016): E2011–E2018
Glycosaminoglycan mimicry by COAM reduces melanoma growth through chemokine induction and function
Authors: Piccard, Helene and Berghmans, Nele and Korpos, Eva and Dillen, Chris and Aelst, Ilse Van and Li, S and ra , undefined and Martens, Erik and Liekens, S and ra , undefined and Noppen, Sam and Damme, Jo Van and others, undefined
Journal: International Journal of Cancer (2012): E425–E436
Referencias
Ver todas las 49 referencias: Citation Explorer
Sequential ordering among multicolor fluorophores for protein labeling facility via aggregation-elimination based beta-lactam probes
Authors: Sadhu KK, Mizukami S, Watanabe S, Kikuchi K.
Journal: Mol Biosyst (2011): 1766
Visualizing dengue virus through Alexa Fluor labeling
Authors: Zhang S, Tan HC, Ooi EE.
Journal: J Vis Exp. (2011)
Fluorescent “Turn-on” system utilizing a quencher-conjugated peptide for specific protein labeling of living cells
Authors: Arai S, Yoon SI, Murata A, Takabayashi M, Wu X, Lu Y, Takeoka S, Ozaki M.
Journal: Biochem Biophys Res Commun (2011): 211
Neuroanatomical basis of clinical joint application of “Jinggu” (BL 64, a source-acupoint) and “Dazhong” (KI 4, a Luo-acupoint) in the rat: a double-labeling study of cholera toxin subunit B conjugated with Alexa Fluor 488 and 594
Authors: Cui JJ, Zhu XL, Ji CF, Jing XH, Bai WZ.
Journal: Zhen Ci Yan Jiu (2011): 262
Simultaneous detection of virulence factors from a colony in diarrheagenic Escherichia coli by a multiplex PCR assay with Alexa Fluor-labeled primers
Authors: Kuwayama M, Shigemoto N, Oohara S, Tanizawa Y, Yamada H, Takeda Y, Matsuo T, Fukuda S.
Journal: J Microbiol Methods (2011): 119
Alexa Fluor 546-ArIB[V11L;V16A] is a potent ligand for selectively labeling alpha 7 nicotinic acetylcholine receptors
Authors: Hone AJ, Whiteaker P, Mohn JL, Jacob MH, McIntosh JM.
Journal: J Neurochem (2010): 994
Asymmetric trimethine 3H-indocyanine dyes: efficient synthesis and protein labeling
Authors: Song F, Wang L, Qiao X, Wang B, Sun S, Fan J, Zhang L, Peng X.
Journal: Org Biomol Chem (2010): 4249
Neuroanatomical characteristics of acupoint “Chengshan” (BL 57) in the rat: a cholera toxin subunit B conjugated with Alexa Fluor 488 method study
Authors: Zhu XL, Bai WZ, Wu FD, Jiang J, Jing XH.
Journal: Zhen Ci Yan Jiu (2010): 433
Photoactivatable and photoconvertible fluorescent probes for protein labeling
Authors: Maurel D, Banala S, Laroche T, Johnsson K.
Journal: ACS Chem Biol (2010): 507
Novel Alexa Fluor-488 labeled antagonist of the A(2A) adenosine receptor: Application to a fluorescence polarization-based receptor binding assay
Authors: Kecskes M, Kumar TS, Yoo L, Gao ZG, Jacobson KA.
Journal: Biochem Pharmacol (2010): 506
Ver todas las 49 referencias: Citation Explorer